Hierro
I dag er Hierro et tema som har fanget oppmerksomheten til mange mennesker rundt om i verden. Siden fremveksten har Hierro skapt stor interesse og vært gjenstand for debatt i ulike miljøer. Hierro har gjennom årene vist seg å være relevant på ulike områder, fra teknologi til politikk, kultur og samfunn generelt. Når vi fortsetter å utforske og analysere Hierro, er det viktig å forstå dens innvirkning på våre daglige liv og verden rundt oss. I denne artikkelen skal vi fordype oss i betydningen av Hierro og dens innflytelse på ulike aspekter av dagens samfunn.
| Hierro | |||
|---|---|---|---|
 | |||
| Geografi | |||
| Plassering | Atlanterhavet | ||
| Øygruppe / del av | Canary Islands | ||
| Areal | 269 kvadratkilometer | ||
| Høyeste punkt | Malpaso (1 501) | ||
| Administrasjon | |||
| Land | Spania | ||
| Største bosetning | Valverde | ||
| Demografi | |||
| Befolkning | 10 587 (2016) | ||
| Posisjon | |||
 Hierro 27°45′N 18°00′V | |||
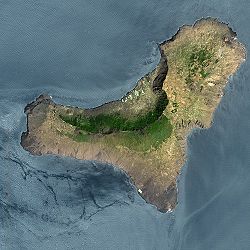
Hierro (spansk: El Hierro) er den vestligste og sørligste av Kanariøyene. Den tilhører den autonome regionen Kanariøyene og provinsen Santa Cruz de Tenerife. Øya har en befolkning på 10 587 (2016).[1] Valverde er største by på øya.
Geografi

Øya er en skjoldvulkan. I oktober 2011 startet et undersjøisk utbrudd utenfor sørspissen av øya. Det varte til mars 2012.[2]
Høyeste punkt er Malpaso som når 1501 moh.[3]
Et 277,7 km² stort område som omfatter deler av øyas landareal og tilstøtende hav er vernet som biosfærereservat.[4]
Politikk og forvaltning
Øya har et folkevalgt øyråd (cabildo insular), Cabildo de El Hierro. Det er i tillegg tre kommuner på øya: Valverde, La Frontera og El Pinar.
Samferdsel
Ved Valverde ligger øyas flyplass, som per april 2017 hadde forbindelse med Gran Canaria og Tenerife trafikkert av flyselskapet Binter Canarias.[5] I 2016 hadde flyplassen 156 439 passasjerer, en økning på 6,6 % fra året før.[6]
Puerto de La Estaca på østkysten har fergeforbindelse med Tenerife.
Referanser
- ^ Cifras oficiales de población resultantes de la revisión del Padrón municipal a 1 de enero, Instituto Nacional de Estadística. Lest 15. april 2017.
- ^ «Latest Activity Reports», Global Volcanism Program, Smithsonian Institution. Lest 16. april 2017.
- ^ Reseña de vértice geodésico: Malpaso[død lenke], Instituto Geográfico Nacional.
- ^ Isla de El Hierro, Unesco. Lest 15. april 2017.
- ^ «Destinos del aeropuerto», Aena. Lest 16. april 2017.
- ^ Tráfico de Pasajeros, Operaciones y Carga en los Aeropuertos Españoles, Aena. Lest 16. april 2017.
Eksterne lenker
- El Hierro, Turismo de Canarias
- Liste over alle plantearter på øya - Flora de Canarias